-
 본 문서는 PDF문서으로 복사 및 편집이 불가합니다.
본 문서는 PDF문서으로 복사 및 편집이 불가합니다.
미리보기
소개
(참고 누락)목차
1. Observation
2. Result
3. Discussion
4. Reference본문내용
Observation
이번 실험은 KMnO4 표준 용액을 제조하여 Na2C2O4 용액과 Mohr’s salt이 들어있는 용액에 적정하여 종말점을 구하는 실험이었다.
KMnO4는 흑색을 띠는 결정성 고체였다. 이 고체를 증류수에 용해하여 표준 용액을 만들었더니 용액의 색이 진한 보라색을 띠었다. 용액의 색이 진한 보라색을 띠는 이유는 KMnO4가 용매에 녹아 이온화되었을 때 MnO4- 이온이 보라색을 띠는 물질이기 때문이다.
그리고 KMnO4 표준 용액을 제조하는 과정에서 용액을 약 70°C 까지 가열을 하였다. 가열을 한 이유는 용액 내 KMnO4가 K+와 MnO4-의 이온으로 최대한 존재하게 하기 위해서이다.
Discussion
(1) 산화 환원 적정법
산화 환원 적정법은 산화제 또는 환원제 표준 용액을 이용하여 분석 물질을 산화 또는 환원을 시키는데, 사용한 산화제 또는 환원제의 양을 측정하여 분석 물질의 정량을 측정하는 부피 분석법이다. 이번 실험에서 제조한 KMnO4 표준 용액은 화학 반응에서 산화제로 작용하였다. 산화 환원은 용액 내에 전자의 이동에 의해서 동시에 반응을 하는데, KMnO4는 분석 용액으로부터 전자를 받아서 환원을 가진다. 반대로 전자를 KMnO4에게 준 분석 용액은 산화를 가진다.
첫 번째 실험에서는 Na2C2O4 에서의 C2O42- 이온이 KMnO4에게 전자 하나를 주면서 산화한다. 두 번째 실험에서는 Mohr’s salt에서의 Fe(II) 이온이 전자 하나를 주면서 산화한다.
C2O42-→ 2CO2+ e-
Fe2+→ Fe3++ e-
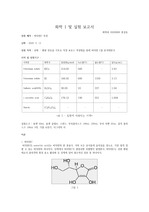
이번 실험에서 무색의 분석 용액에 보라색의 적정제를 첨가하였음에도 불구하고, 당량점 이전에서 용액의 색이 무색을 나타내는 이유는 KMnO4의 산화 때문이다. KMnO4의 MnO4- 이온은 보라색을 띠는 이온이다. MnO4- 이온은 화학 반응을 통해 전자와 수소를 얻고, 산소를 잃게 된다. 화학 반응식은 다음과 같다참고자료
· 없음태그
-
자료후기
Ai 리뷰지식판매자가 제공한 자료는 전문 지식를 바탕으로 한 내용이 많아, 과제에 쉽게 적용할 수 있었습니다. 매우 만족스러웠습니다. 정말 감사드립니다! -
자주묻는질문의 답변을 확인해 주세요

꼭 알아주세요
-
자료의 정보 및 내용의 진실성에 대하여 해피캠퍼스는 보증하지 않으며, 해당 정보 및 게시물 저작권과 기타 법적 책임은 자료 등록자에게 있습니다.
자료 및 게시물 내용의 불법적 이용, 무단 전재∙배포는 금지되어 있습니다.
저작권침해, 명예훼손 등 분쟁 요소 발견 시 고객센터의 저작권침해 신고센터를 이용해 주시기 바랍니다. -
해피캠퍼스는 구매자와 판매자 모두가 만족하는 서비스가 되도록 노력하고 있으며, 아래의 4가지 자료환불 조건을 꼭 확인해주시기 바랍니다.
파일오류 중복자료 저작권 없음 설명과 실제 내용 불일치 파일의 다운로드가 제대로 되지 않거나 파일형식에 맞는 프로그램으로 정상 작동하지 않는 경우 다른 자료와 70% 이상 내용이 일치하는 경우 (중복임을 확인할 수 있는 근거 필요함) 인터넷의 다른 사이트, 연구기관, 학교, 서적 등의 자료를 도용한 경우 자료의 설명과 실제 자료의 내용이 일치하지 않는 경우
함께 구매한 자료도 확인해 보세요!
-
산화 환원 적정 예비 보고서 (화학과 분석화학실험) 7페이지
6. 실험 이론 (1) 산화 · 환원 (산화수) 산화 환원은 화학 반응을 하는 과정에서 전자가 이동으로 생기는 반응이다. 산화는 다른 물질에게 전자를 주는 경우를 의미하고, 환원은 다른 물질로부터 전자를 받는 경우를 의미한다. 산화 환원은 전자가 이동하는 과정에서 동시성을 가지고 있다. 다시 말해서, 잃어버린 전자의 수와 얻은 전자의 수가 서로 같.. -
분석화학실험 A+ 보고서 8. Kastle-Meyer test 4페이지
4-1. Principle ① 산화반응(oxidation)¹⁾: 산화수(H⁺,O²⁻와 결합할 수 있는 능력)가 증가하는 반응으로, 환원 반응과 동시에 일어난다. (자신은 산화되며,) 다른 물질을 환원시키는 물질을 환화제라고 한다. ② 환원반응(reduction)¹⁾: 산화수(H⁺,O²⁻와 결합할 수 있는 능력)가 감소하는 반응으로, 산화 반응과 동시에..
찾으시던 자료가 아닌가요?
지금 보는 자료와 연관되어 있어요!
문서 초안을 생성해주는 EasyAI