-
미리보기
소개
액체 증기의 평형 관련 레포트목차
ABSTRACT(요약)
TABLE OF CONTENTS (목차)
LIST OF TABLE
LIST OF FIGURES
1. INTRODUCTION(소개)
1-1. 실험 이론
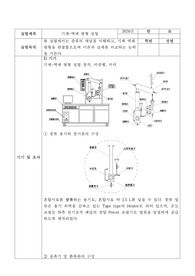
1-2. 실험 기구
1-3. 물리상수
1-3. 실험 중 안전 유의사항
1-1. 실험목적
2. EXPERIMENTAL(실험)
2-1 기구 및 시약
2-2 실험 방법
3. RESULT&DISCUSSION(결과 및 분석)
3-1 Raw Data
3-2 RESULTS
3-3 DISCUSSION
REFERENCES(참고문헌)
본문내용
1-1-1. 라울의 법칙
비휘발성, 비전해질인 용질이 녹아 있는 용액의 증기압내림은 용질의 몰랄 농도에 비례한다는 법칙이다.
1888년 프랑스의 물리화학자 F.M.라울이 실험을 통해 발견한 법칙이다. 비휘발성 물질 용액에서, 용액 속 용매의 증기압은 용매의 몰분율에 비례하며, 또 용매의 증기압내림률은 용질의 몰분율과 같다는 법칙을 말한다.
예를 들면 휘발성인 에탄올을 물에 녹인 용액의 증기압은 물의 증기압보다 높다. 에탄올은 물보다 끓는점이 낮아 쉽게 증발하기 때문에 물이 증발하는 것을 방해하지 않고 그보다 더 빨리 기화하기 때문이다. 그러나 비휘발성인 설탕을 물에 녹인 용액은 설탕 분자가 물이 증발하는 것을 부분적으로 방해하기 때문에 설탕물의 증기압은 물보다 더 낮아진다. 이런 현상이 라울의 법칙이다.
전체 농도 범위에 걸쳐 라울의 법칙이 성립하는 용액을 이상용액이라고 한다. 이에 대해 라울의 법칙에서 예상했던 증기압보다 더 작게 또는 더 크게 나타나는 경우를 비이상용액이라고 한다.
어떤 온도에서 순용매의 증기압을 p0, 같은 온도에서 용액의 증기압을 p, 그 용액 중의 용질의 몰분율을 x2라 하면,
의 관계가 성립한다. 여기서 n1, n2는 각각 용액 중의 용매 또는 용질의 몰수이다. 이 법칙을 이용하여 묽은 용액의 증기압내림을 측정함으로써 용질의 분자량을 구할 수 있다.
용질이 휘발성인 경우에도 p를 용액과 평형 상태에 있는 기체상 중의 용매증기의 부분압력으로 하면 위의 관계가 성립한다. 용매의 몰분율을 x1이라 하면 x1=1-x2이므로, 라울의 법칙은 p=p0x1로 고쳐 쓸 수 있다. [1]참고자료
· [1] http://100.naver.com/100.php?id=53606 : 네이버 백과사전
· [2] http://100.naver.com/100.php?id=126496
· http://blog.naver.com/hgh5236?Redirect=Log&logNo=30001227321
· [3] http://100.naver.com/100.php?id=16246
· [4] http://www.onreport.co.kr/data/171/F170485.html태그
-
자료후기
Ai 리뷰지식판매자가 등록한 자료는 과제에 직접 활용할 수 있는 유용한 내용이 많아, 큰 도움이 되었습니다. 앞으로도 계속 좋은 자료 부탁드립니다! 감사합니다. -
자주묻는질문의 답변을 확인해 주세요

꼭 알아주세요
-
자료의 정보 및 내용의 진실성에 대하여 해피캠퍼스는 보증하지 않으며, 해당 정보 및 게시물 저작권과 기타 법적 책임은 자료 등록자에게 있습니다.
자료 및 게시물 내용의 불법적 이용, 무단 전재∙배포는 금지되어 있습니다.
저작권침해, 명예훼손 등 분쟁 요소 발견 시 고객센터의 저작권침해 신고센터를 이용해 주시기 바랍니다. -
해피캠퍼스는 구매자와 판매자 모두가 만족하는 서비스가 되도록 노력하고 있으며, 아래의 4가지 자료환불 조건을 꼭 확인해주시기 바랍니다.
파일오류 중복자료 저작권 없음 설명과 실제 내용 불일치 파일의 다운로드가 제대로 되지 않거나 파일형식에 맞는 프로그램으로 정상 작동하지 않는 경우 다른 자료와 70% 이상 내용이 일치하는 경우 (중복임을 확인할 수 있는 근거 필요함) 인터넷의 다른 사이트, 연구기관, 학교, 서적 등의 자료를 도용한 경우 자료의 설명과 실제 자료의 내용이 일치하지 않는 경우
찾으시던 자료가 아닌가요?
지금 보는 자료와 연관되어 있어요!
문서 초안을 생성해주는 EasyAI
![[화학]액체 증기의 평형](https://image4.happycampus.com/Production/thumb212/2006/04/13/data4118695-0001.jpg)